ЕГЭ по химии ― 2025: как решить сложное задание 29


В едином государственном экзамене три задания, которые проверяют усвоение тем окислительных и восстановительных реакций: 3, 19 и 29. Первые два редко вызывают проблемы у школьников. По итогам анализа результатов ЕГЭ-2023 задание 3 по теме «Степени окисления» успешно выполнили 63,5 % экзаменуемых, а задание 19 — 71,7 %.
Иначе дело обстоит с заданием 29 из второй части ЕГЭ по химии. Это задание проверяет знание элемента содержания «Окислительно-восстановительные реакции». Процент выполнения по РФ за последние 4 года ниже 35 %.
Сколько школьников справились с заданием 29 в ЕГЭ по химии?
-
2023 год — 31,5 %
-
2022 год — 34,0 %
-
2021 год — 33,2 %
-
2020 год – 33,3 %
Как выглядит задание 29 в ЕГЭ по химии
Для начала давайте посмотрим, как выглядит задание 29 в ЕГЭ по химии — 2024. На скриншоте ниже типичная формулировка сложного задания из экзамена.

Какие навыки помогут решить задание
Выполнить задание 29 ЕГЭ по химии школьнику помогут такие умения:
-
определять степень окисления химических элементов в соединениях;
-
прогнозировать окислительно-восстановительные свойства (или их отсутствие) у вещества по его формуле и степени окисления атомов в его составе;
-
определять окислитель и восстановитель в химической реакции;
-
прогнозировать продукты окислительно-восстановительных реакций, в том числе с учётом характера среды (кислой, щелочной, нейтральной), концентрации реагентов;
-
составлять уравнения окислительно-восстановительных реакций;
-
составлять электронный баланс и на его основе расставлять коэффициенты в уравнениях реакций.
Какие теоретические знания нужны для выполнения задания 29 ЕГЭ по химии
При выборе веществ из списка для написания окислительно-восстановительной реакции первым делом нужно определить, характерны ли для этих веществ окислительные или восстановительные свойства.
Важная особенность задания 29 в том, что окислители и восстановители в представленных превращениях ведут себя «стандартным образом», то есть восстанавливаются и окисляются до одних и тех же соединений. Различаться могут формы в кислой и нейтральной среде, а также катионы в составе солей.
Характерные окислители и их «стандартные переходы»
|
Группа окислителей |
Химический элемент |
Примеры веществ |
Стандартное уравнение полуреакции |
|
Галогены в положительных с. о. |
Hal+7, Hal+5, Hal+3, Hal+1 |
KClO4, KClO3, NaBrO3, KClO |
Hal+7 + 8ē → Hal–1 Hal+5 + 6ē → Hal–1 Hal+3 + 4ē → Hal–1 Hal+1 + 2ē → Hal–1 |
|
Халькогены в положительных с. о. |
S+6, S+4 (редко) |
H2SO4(конц.), SO2 (редко) |
Окисление сложных веществ и неметаллов (чаще всего): S+6 + 2ē → S+4 (SO2) |
|
Пниктогены в положительных с. о. |
N+5, N+3, N+4, N+2, N+1 (редко) |
HNO3, нитраты, нитриты |
Окисление сложных веществ и неметаллов (чаще всего): конц. HNO3 и нитраты N+5 + ē → N+4 (NO2) разб. HNO3 N+5 + 3ē → N+2 (NO) |
|
Неметаллы — простые вещества |
Hal0, O0, S0 (редко) |
F2, Cl2, Br2, O2, O3, S (редко) |
Hal2+ 2ē → 2Hal–1 S + 2ē → S–2 O2 + 4ē → 2O–2 O3 + 6ē → 3O–2 |
|
Неметаллы в промежуточных отрицательных с. о. |
O–1 |
H2O2, Na2O2, BaO2 |
Рассмотрим далее |
|
Металлы в высших положительных с. о. |
Mn+7, Cr+6, Fe+6, Cu+2 |
KMnO4, K2Cr2O7, K2CrO4, K2FeO4, Cu(OH)2, CuO |
Рассмотрим далее |
|
Металлы в положительных с. о. |
Mn+4, Fe+3 |
MnO2, FeCl3 |
Fe+3 + ē → Fe+2 Mn+4 + 2ē → Mn+2 |
Характерные восстановители и их «стандартные переходы»
|
Группа восстановителей |
Химический элемент |
Примеры веществ |
Стандартное уравнение полуреакции |
|
Неметаллы в низшей отрицательной с. о. |
Hal–1, S–2, N–3, P–3 |
HCl (редко), HBr, HI, бромиды, иодиды, H2S, сульфиды, NH3, PH3 |
2Hal–1 – 2ē → Hal20 S–2 – 2ē → S0 2N–3 – 6ē → N20 P–3 – 8ē → P+5 |
|
Неметаллы в промежуточных отрицательных с. о. |
O–1 |
H2O2, Na2O2, BaO2 |
Рассмотрим далее |
|
Неметаллы — простые вещества |
H0, S0, P0, C0, I0 |
H2, S, P, C, I2 |
Зависит от условий |
|
Неметаллы в промежуточных положительных с. о. |
S+4, C+2, N+3 |
Сульфиты, SO2, CO, нитриты |
S+4 – 2ē → S+6 C+2 – 2ē → C+4 |
|
Металлы — простые вещества |
Me0 |
Na, Al, Fe, Zn |
Металлы с постоянной с. о. окисляются до неё: Na0 – ē → Na+1 Al0 – 3ē → Al+3 Продукты восстановления металлов в промежуточных с. о. зависят от условий: Fe0 – 2ē → Fe+2 Fe0 – 3ē → Fe+3 |
|
Металлы в промежуточных положительных с. о. |
Fe+2, Cu+1, Cr+3, Cr+2 |
FeCl2, CuCl, Cr2O3, CrO |
Зависит от условий, но обычно окисляются до более высокой стабильной степени окисления |
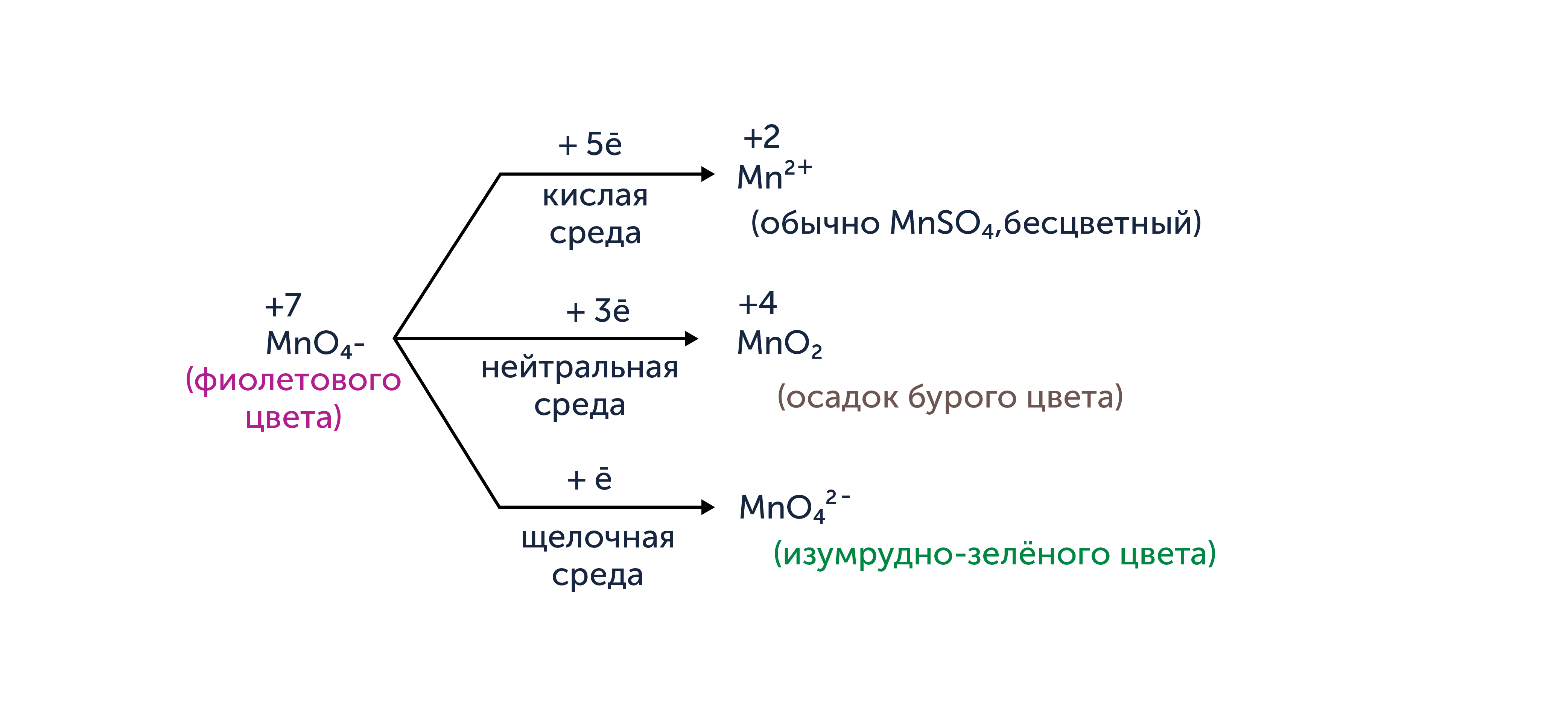
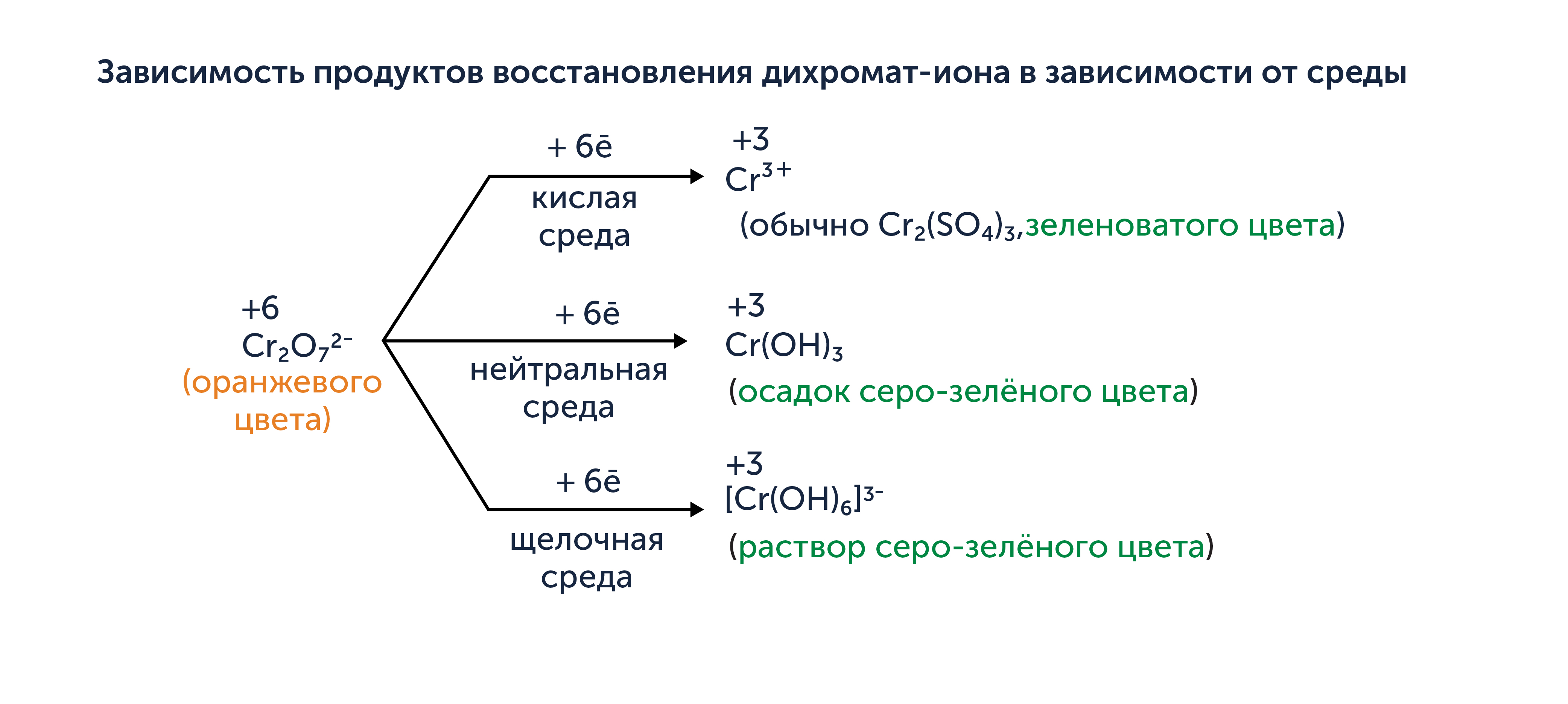
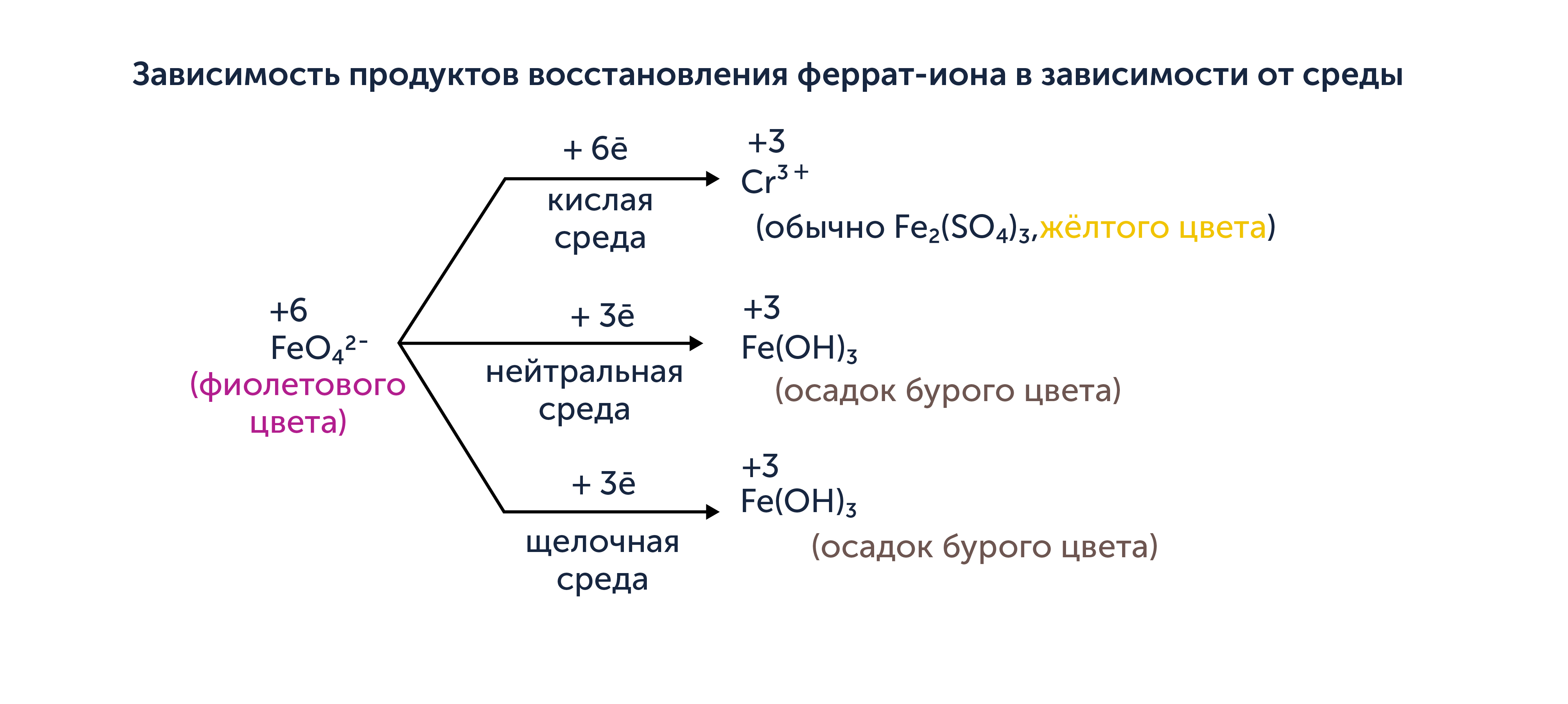
При выполнении задания также важно исходить из того, что некоторые окислители (перманганаты, дихроматы и ферраты) в зависимости от характера среды (величины водородного показателя pH) будут восстанавливаться до различных продуктов. Давайте разберёмся на примерах. На схемах ниже вы увидите продукт восстановления окислителей, а также количество принятых окислителем электронов (с учётом числа атомов окислителя в исходной частице) в результате этого превращения. Кислая среда обычно создаётся добавлением серной кислоты.
Зависимость продуктов восстановления перманганат-иона в зависимости от среды
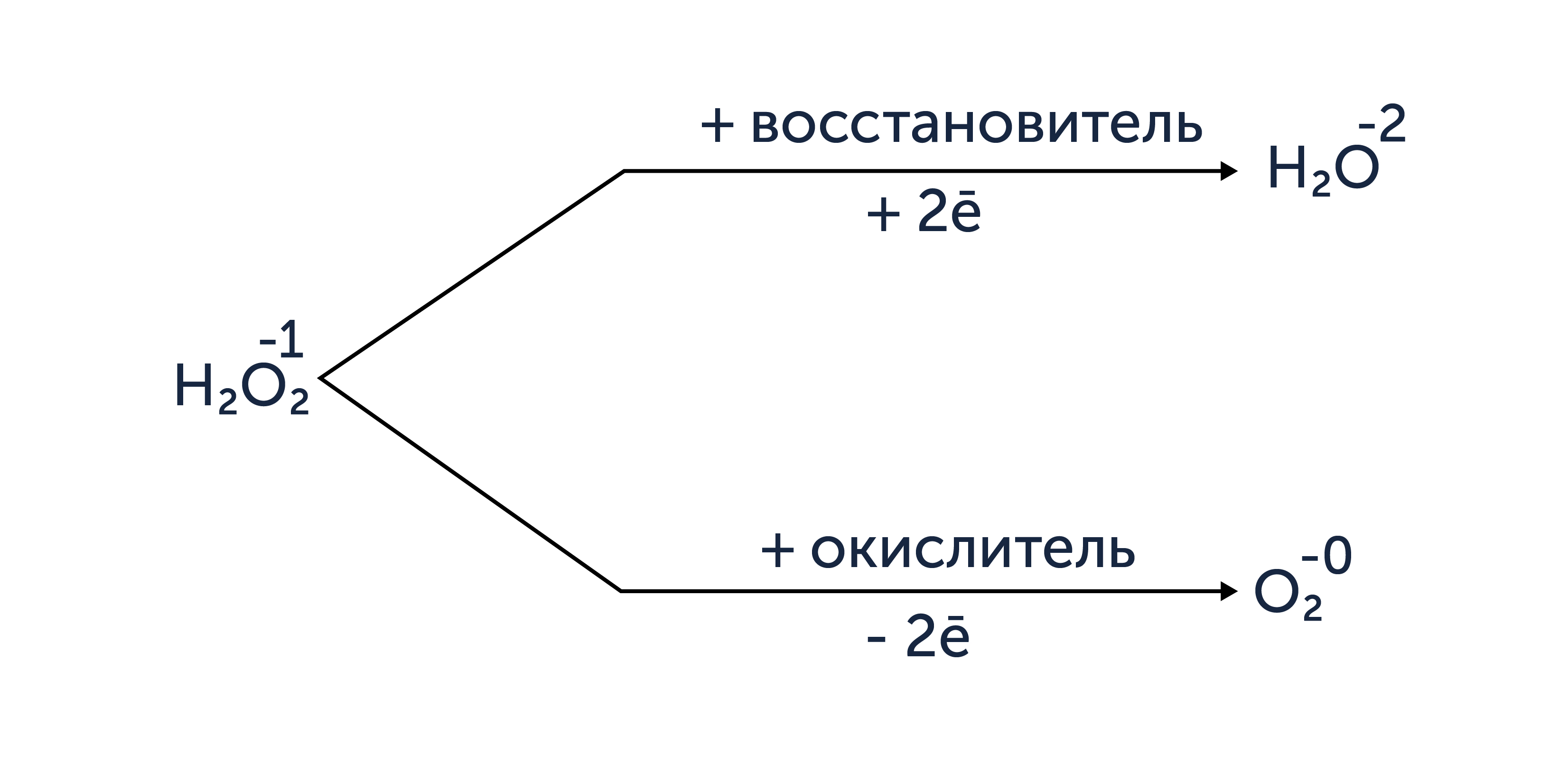
При выполнении задания 29 также следует учитывать, что вещества, содержащие атомы в промежуточных степенях окисления, проявляют окислительно-восстановительную двойственность: в зависимости от второго участника реакции могут выступать как в роли восстановителя, так и окислителя. Наиболее важную роль среди таких веществ играют пероксиды и нитриты. У пероксидов наиболее ярко всё же выражены окислительные свойства, в то время как у нитратов преобладают восстановительные свойства.
Окислительно-восстановительная двойственность пероксидов на примере пероксида водорода
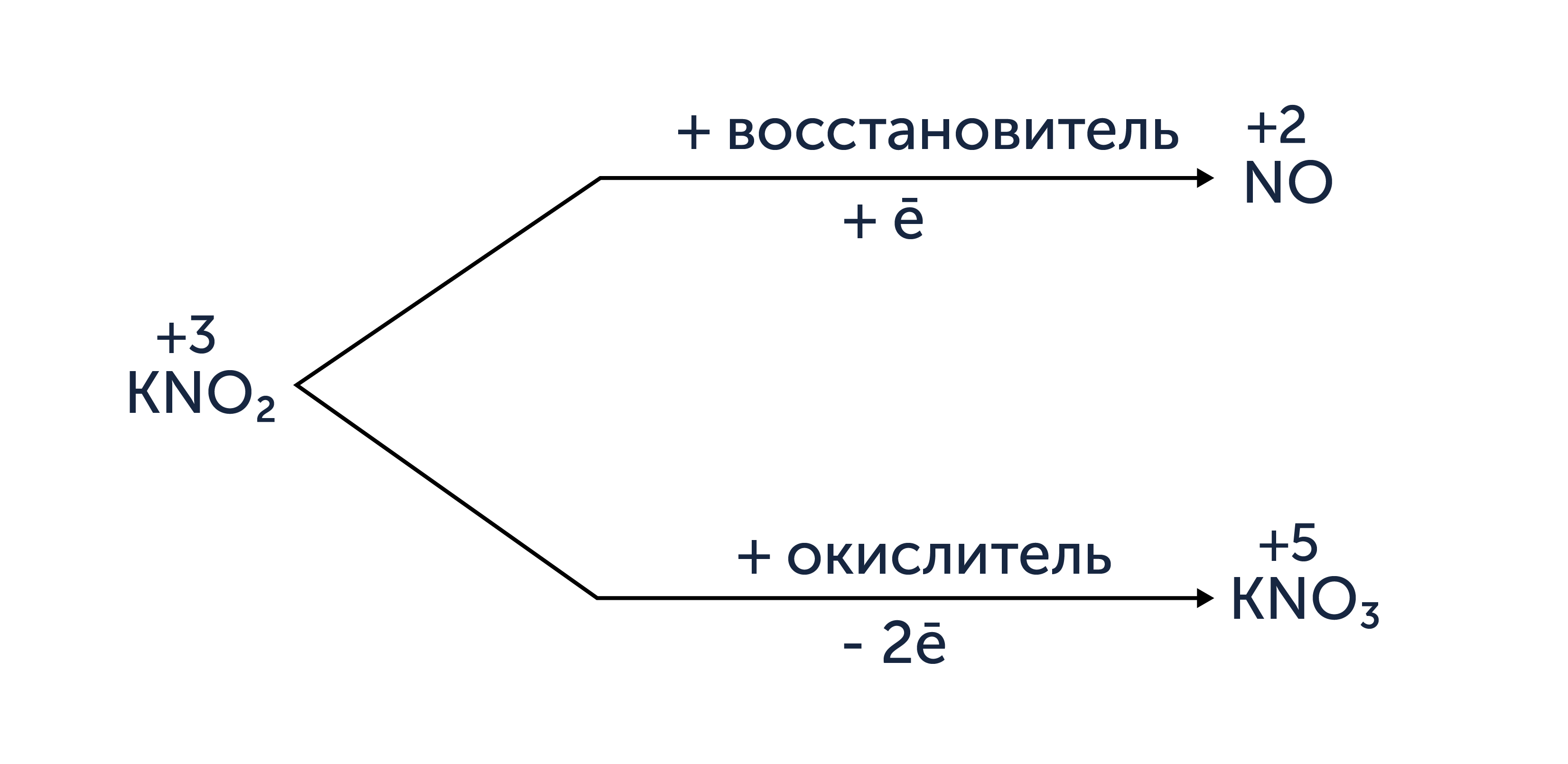
Окислительно-восстановительная двойственность нитритов на примере нитрита калия
Как решать задание 29 ЕГЭ по химии
Пусть вас больше не пугают сложность задания и большое разнообразие реакций, которые могут в нём встретиться. Справиться с заданием 29 в ЕГЭ по химии поможет проверенный алгоритм.
Алгоритм, как решить задание 29 в ЕГЭ по химии:
-
Записать формулы представленных соединений и определить степени окисления атомов в них.
-
Спрогнозировать окислительно-восстановительные свойства веществ.
-
Выявить среди соединений типичные окислители и восстановители (справиться помогут таблицы из этой статьи).
-
Написать все возможные варианты схем реакций между окислителями и восстановителями с учётом характера среды, если кислоты или щёлочи даны среди веществ. В нейтральной среде рассматривать следует всегда. Для предсказания продуктов следует использовать «стандартные переходы» окислителей и восстановителей из таблиц в этой статье.
-
Найти ограничения, предъявляемые к требуемой окислительно-восстановительной реакции (так называемые «фильтры»). Например, могут быть указаны классы реагирующих веществ или продуктов реакции, признаки реакции, число отданных восстановителем или принятых окислителем электронов.
-
Выбирать из составленных на шаге 4 схем реакций такую, которая удовлетворяет включённым в условие «фильтрам» (шаг 5).
-
Записать электронный баланс для выбранной реакции.
-
Указать окислитель и восстановитель.
-
Расставить коэффициенты в уравнении.
3 важных факта, которые следует учитывать в задании 29 ЕГЭ по химии:
-
В качестве окислителя и восстановителя могут быть использованы только вещества из предложенного в условиях списка (вода используется в качестве среды протекания реакций).
-
Реакции разложения сложных веществ не могут быть приняты в качестве верного ответа, так как по условию задания требуется выбрать «вещества, между которыми протекает реакция».
-
Реакции диспропорционирования, которые протекают с участием среды (раствора щёлочи или кислоты, указанными в перечне веществ), засчитываются как верные.
Как оценивают задание 29
Задание 29 ЕГЭ по химии максимально оценивают в 2 балла. В соответствии с критериями оценивания, разработанными ФИПИ, первый балл выставляется, если верно выбраны вещества и записано уравнение окислительно-восстановительной реакции (элемент ответа № 1). Верно записанным считается уравнение химической реакции между верно выбранными веществами из списка, в котором корректно написаны формулы продуктов и отсутствуют ошибки в стехиометрических коэффициентах.
Второй балл выставляется, если верно составлен электронный баланс и указаны окислитель и восстановитель (элемент ответа № 2). Балл за второй элемент ответа выставляется, если:
-
правильно указаны степени окисления элемента-окислителя и элемента-восстановителя, участвующих в процессах окисления и восстановления, указаны (знаками + и –) процессы принятия и отдачи электронов;
-
в ответе показано, что число отданных восстановителем электронов равно числу электронов, принимаемых окислителем. Это могут быть коэффициенты в уравнении полуреакции в электронном балансе, множители за вертикальной чертой, текстовая запись о числе отданных и присоединённых электронов или метод полуреакций (электронно-ионный баланс);
-
указаны окислитель и восстановитель любым способом. Например, под соответствующей частицей в электронном балансе, отдельно после или рядом с электронным балансом, под веществами в уравнении химической реакции.
При записи электронного баланса полезно помнить, что:
-
степень окисления 0 можно не указывать;
-
если степень окисления не указана, то её считают равной 0;
-
верными считаются записи, подобные следующим: Cl–, 2Cr3+, которые используются при указании степени окисления, только если такие частицы реально существуют в рассматриваемой реакции;
-
неверными считаются записи, подобные следующим: N23–, Cr26+ (или N2–3, Cr2+6).
И ещё один нюанс. Если уравнение записано неверно (выбраны вещества не из списка, неверно определены продукты реакции, неверно расставлены коэффициенты в уравнении), за первый элемент ответа выставят 0 баллов. Тогда и второй элемент ответа не станут оценивать, даже если он выполнен абсолютно верно.
Все эти детали сложно запомнить. Их важно натренировать практикой. Самостоятельно это получится далеко не у каждого. Намного надёжнее заниматься с экспертами: получать от них развёрнутую обратную связь по решённым заданиям с разбором ошибок и подробным объяснением непонятных нюансов.
Примеры решения задания 29 ЕГЭ по химии
А теперь разберём два примера задания 29 и потренируемся, как их решать.
Пример 1

Решение
Среди представленных веществ (KClO, KOH, Fe2(SO4)3, Cr2O3, MgO) ярко выраженные окислительные свойства может проявлять гипохлорит калия KClO (за счёт хлора в с. о. +1). А восстановительные свойства характерны для сульфата железа Fe2(SO4)3 и оксида хрома (III) Cr2O3. Следует учесть, что окислительные свойства гипохлорита проявляются лишь в щелочной среде. Таким образом, потенциально могут подойти две комбинации окислителя и восстановителя:
Fe2(SO4)3 + KClO + KOH → и Cr2O3 + KClO + KOH →
Окислить трёхвалентное железо до более высокой степени окисления трудно. Ферраты, содержащие Fe+6, могут быть получены из соединений Fe+3 лишь действием хлора в щелочной среде или методом щелочного плава (KNO3 + KOH). Следовательно, остаётся лишь реакция окисления оксида хрома (III).
Определим продукты, исходя из «стандартных» переходов:
Cr2O3 + KClO + KOH → K2CrO4 + KCl + H2O
По условию задания реакция должна сопровождаться образованием жёлтого раствора. Предложенная схема удовлетворяет этому условию: раствор хромата калия в воде как раз жёлтый.
Электронный баланс:
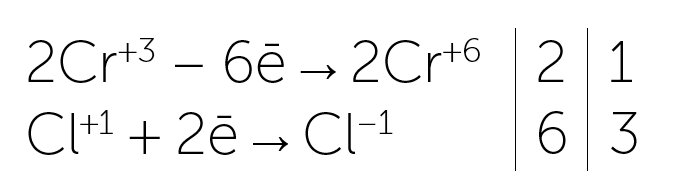
Cr+3 — восстановитель, Cl+1 — окислитель.
Уравнение химической реакции:
Cr2O3 + 3KClO + 4KOH = 2K2CrO4 + 3KCl + 2H2O
Пример 2

Решение
Среди представленных веществ (HBr, PH3, K2HPO4, BaBr2, CuCO3 и KMnO4) ярко выраженные окислительные свойства может проявлять перманганат калия KMnO4 (за счёт марганца в с. о. +7), восстановительные же свойства характерны для бромоводорода HBr, фосфина PH3 и бромида бария BaBr2.
Использовать бромоводородную кислоту в качестве среды нельзя, так как она будет сама взаимодействовать с перманганатом по схеме:
KMnO4 + HBr → MnBr2 + Br2 + KBr + H2O
Эта схема не удовлетворяет условию задания: среди продуктов нет бурого осадка, хотя присутствуют две соли одной и той же кислоты.
Таким образом, потенциально могут подойти две комбинации окислителя и восстановителя:
KMnO4 + BaBr2 → и KMnO4 + PH3 →
Для первой схемы, исходя из соображений, отражённых в «стандартных переходах», продуктами будут являться оксид марганца (IV) (бурый осадок), бром Br2, бромид калия и гидроксид бария (один из вариантов):
KMnO4 + BaBr2 + H2O → MnO2 + Br2 + KBr + Ba(OH)2
Предложенная схема удовлетворяет этому условию частично: среди продуктов есть вещество, выпадающее в виде бурого осадка (MnO2), и лишь одна соль.
Определим продукты во второй схеме, исходя из «стандартных переходов»:
KMnO4 + PH3 → MnO2 + K3PO4 + H2O
По условию реакция должна протекать с образованием осадка бурого цвета и двух солей одной и той же кислоты. Предложенная схема удовлетворяет этому условию частично: среди продуктов есть вещество, выпадающее в виде бурого осадка (MnO2), и лишь одна соль. Учитывая, что в левой части атомов водорода больше, чем в правой, можно предположить, что часть из них могла пойти на образование кислой соли ортофосфорной кислоты — гидрофосфата калия. Тогда схема реакции примет вид:
KMnO4 + PH3 → MnO2 + K3PO4 + K2HPO4 + H2O
Электронный баланс:
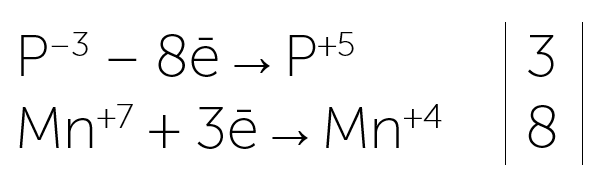
Cr+3 — восстановитель, Cl+1 — окислитель.
Уравнение химической реакции:
8KMnO4 + 3PH3 = 8MnO2 + 2K3PO4 + K2HPO4 + 4H2O
В этой статье мы рассмотрели основные подходы к решению, оформлению и оцениванию задания 29 ЕГЭ по химии. Для закрепления материала предлагаем вам почувствовать себя в роли эксперта ЕГЭ: потренироваться в оценивании ответов к заданию 29.

















































 09 января 2024
09 января 2024  12 993
12 993
 Статья
Статья